美国西北大学团队利用纳米医学新技术,在癌症治疗领域取得突破性进展:通过重新设计一种常见化疗药物的分子结构,显著提升了其溶解性、靶向性和疗效,使其杀死癌细胞的能力提升达20000倍,同时大幅降低毒性。这项技术在动物试验中清除了白血病细胞,为治疗难治性癌症带来新希望。相关研究发表于最新一期《ACS 纳米》杂志。
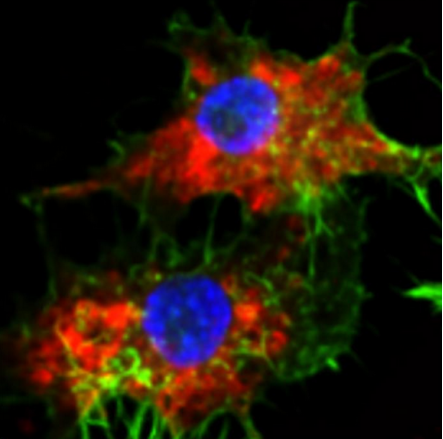 SNA进入细胞。
SNA进入细胞。
图片来源:美国西北大学
团队聚焦于一种广泛使用的化疗药物——5-氟尿嘧啶(5-Fu)。尽管该药在多种癌症治疗中应用多年,但其临床效果受制于两大缺陷:一是水溶性极差,导致在体液中难以溶解,吸收率不足1%;二是缺乏靶向性,会无差别攻击健康组织,引发严重副作用。
团队另辟蹊径,没有改良药物本身,而是改变其递送方式。他们利用自主研发的“球形核酸”(SNA)技术,从头设计了一种新型纳米药物。SNA是一种球状纳米结构,其核心为微小颗粒,表面覆盖着密集排列的DNA链。研究人员将5-Fu分子直接化学整合进这些DNA链中,使药物成为纳米结构的一部分。
这种结构设计带来了革命性变化。SNA能够被细胞表面的“清道夫受体”迅速识别,尤其是骨髓细胞(包括AML癌细胞)会过度表达这类受体,因而更易主动吸收SNA。与传统化疗药物被动扩散不同,SNA是被细胞“邀请”进入的。
一旦进入细胞内部,细胞内的酶会分解DNA外壳,精准释放药物,在癌细胞内部实现“定点爆破”。这种机制不仅提高了药物在靶细胞内的浓度,也避免了对健康组织的伤害。
在急性髓性白血病的小鼠模型中,新疗法展现出惊人效果:除杀死癌细胞能力巨幅提升外,药物进入白血病细胞的效率比传统5-Fu提高12.5倍;癌症进展速度减缓59倍。尤为关键的是,实验中未检测到任何明显副作用。
研究显示,该疗法几乎清除了小鼠血液和脾脏中的白血病细胞,显著延长了生存期。团队认为,若该成果能成功转化为人类疗法,意味着更高效的化疗、更高的缓解率和更低的毒性,真正实现癌症治疗的长期目标。下一步,团队计划在更大的动物模型中验证该策略,随后开展人体临床试验。
(来源:科技日报 记者:张梦然)


发表评论 取消回复